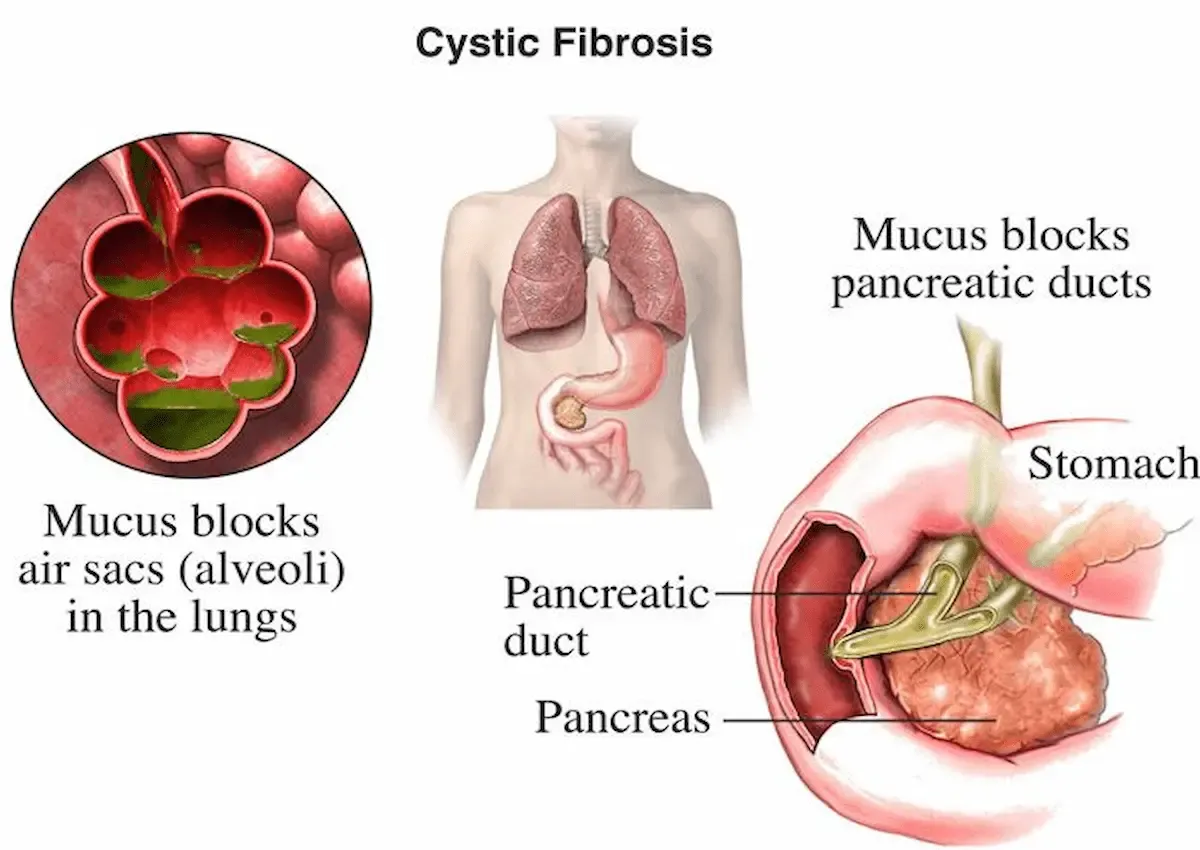
فیبروز کیستیک (Cystic Fibrosis – CF) یک بیماری ژنتیکی پیچیده و طولانیمدت است که بر عملکرد ریه، پانکراس، کبد و سیستم گوارشی اثر میگذارد. علت بروز آن جهش در ژن CFTR روی کروموزوم ۷q31.2 است. این ژن تنظیمکننده جریان کلر (Cl-) و سدیم (Na+) از غشای سلولهاست و تعادل آب در سطح بافتها را حفظ میکند. زمانی که دچار نقص میشود، مایع مخاطی بدن چسبنده و غیرطبیعی میگردد و مجاری حیاتی را مسدود میکند. بیماری اتوزوم مغلوب (Autosomal Recessive) است؛ بیمار تنها زمانی مبتلا میشود که از هر دو والد ژن معیوب را دریافت کند. شیوع CF حدود ۱ در هر ۲۵۰۰ تولد است و در ایران حدود ۳ تا ۴ هزار بیمار فعال گزارش شدهاند. امروزه با درمانهای جدید، طول عمر مبتلایان به بیش از ۴۵ سال رسیده است. شناخت مکانیزم ژن CFTR، اولین گام در کنترل و درمان این اختلال پیچیده است.
فیبروز کیستیک چیست؟
فیبروز کیستیک باعث تولید مخاط سنگین و چسبنده میشود که راههای تنفسی و مجاری شیرههای گوارشی را مسدود میکند. این مخاط مانع جریان طبیعی هوا و مواد غذایی است و در نتیجه التهابات شدید، سرفه مزمن و ضعف جذب غذایی رخ میدهد. این بیماری به مرور عملکرد ریهها را کاهش میدهد و خطر عفونتهای مزمن Pseudomonas aeruginosa را بالا میبرد.
نقص پروتئین CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) عامل اصلی این تغییرات است. CFTR همان کانال یونی است که انتقال یونهای کلر و سدیم را میان سلول تنظیم میکند. وقتی عملکرد این پروتئین مختل شود، مخاط ریه خشک میگردد و باکتریها بهراحتی رشد میکنند.
ویژگی ظاهری بارز بیماران، عرق شورتر از حد معمول است. دلیل آن افزایش سدیم در غدد عرق است. این علامت در نوزادی خود را نشان میدهد و نخستین نشانه هشداردهنده بیماری محسوب میشود.
CF تنها بیماری تنفسی نیست؛ بلکه کل بدن را تحتتأثیر قرار میدهد. به همین دلیل پزشکان آن را چندسیستمی (Multisystemic) مینامند.
این بیماری از نخستین هفتههای زندگی شروع میشود و در بزرگسالی علائم پایدار میمانند. پیشرفت آن کند است اما بدون درمان، آسیبهای برگشتناپذیر ایجاد میکند.
بهبود شرایط بیمار با مراقبت مداوم، تغذیه صحیح و درمانهای CFTR Modulator ممکن است. این داروها عملکرد ژن را در سطح سلولی تنظیم کرده و مخاط را به حالت طبیعی نزدیک میکنند.
علت بیماری و نحوه انتقال ژنتیکی
CF یک بیماری ارثی اتوزوم مغلوب است. وقتی هر دو والد ناقل ژن معیوب باشند، احتمال تولد کودک مبتلا ۲۵٪ است. ناقل بودن به معنای داشتن تنها یک نسخه معیوب از ژن است؛ شخص ناقل بیمار نیست اما میتواند بیماری را منتقل کند.
بیش از ۲۰۰۰ نوع جهش ژنی CFTR شناخته شده است. بعضی باعث از بین رفتن کامل پروتئین و برخی تنها فعالیت آن را کاهش میدهند. این جهشها شدت و پیشرفت بیماری را تعیین میکنند.
در مطالعات ایرانی، دو منطقه بحرانی اگزون ۱۱ و ۱۳ ژن CFTR بیشترین نقش را در بروز اختلال داشتهاند. این یافتهها برای برنامههای غربالگری ژنتیکی قبل از ازدواج و انتخاب جنین سالم اهمیت دارند.
CF روی کروموزوم هفت قرار دارد و به جنسیت وابسته نیست. درصد ناقلین در برخی جمعیتها تا ۱ به ۲۵ نفر است که نرخ بالایی محسوب میشود.
بررسی ژنتیکی خانوادهها میتواند از تولد کودکان بیمار جلوگیری کند. مشاوره ژنتیک، آزمایش مولکولی و بررسی جهشهای خاص از مهمترین اقدامات پیشگیرانه هستند.
جدول زیر روند وراثت CF را خلاصه میکند:
| والدین | احتمال فرزند سالم | احتمال فرزند ناقل | احتمال فرزند مبتلا |
|---|---|---|---|
| هر دو سالم | 100٪ | 0٪ | 0٪ |
| یک ناقل + یک سالم | 50٪ | 50٪ | 0٪ |
| هر دو ناقل | 25٪ | 50٪ | 25٪ |
این الگوی وراثت باعث میشود بیماری در خانوادههایی با ازدواج فامیلی بیشتر دیده شود.
اندامهای تحت تأثیر فیبروز کیستیک
CF تنها به ریه محدود نیست بلکه چندین اندام را همزمان درگیر میکند. ریهها بیشترین آسیب را میپذیرند؛ مخاط غلیظ راههای هوایی را مسدود و تبادل اکسیژن را کاهش میدهد. سرفه مزمن، خسخس سینه و عفونت باکتریایی شایعترین نشانههای ریوی هستند.
در پانکراس، انسداد مجاری ترشح باعث کاهش عبور آنزیمهای گوارشی میشود. نتیجۀ آن اسهال چرب (Steatorrhea) و سوءتغذیه است. بیماران باید مکمل آنزیمهای پانکراس مصرف کنند تا مواد غذایی را جذب کنند.
کبد و رودههای کوچک نیز درگیر میشوند. انسداد مجاری صفرا سبب تجمع چربیها و یرقان میشود. در نوزادان، یکی از تظاهرات اصلی، انسداد روده (Meconium Ileus) است.
غدد عرق نیز عملکرد متفاوتی دارند؛ پوست افراد مبتلا شورتر از حالت طبیعی است. این ویژگی در تشخیص اولیه بیماری بسیار مفید است.
در دستگاه تولیدمثل مردان، CF اغلب باعث ناباروری میشود زیرا مجاری اسپرم انسداد دارند. در زنان نیز ترشحات دهانه رحم چسبندهتر میشوند و باروری را کاهش میدهند.
CF با تأثیر روی سیستم ایمنی بدن، مقاومت در برابر عفونتها را کم میکند. بنابراین بیماران در معرض عفونتهای مکرر و مزمن هستند.
همهی این تغییرات نشان میدهند فیبروز کیستیک یک بیماری چندسیستمی با تأثیرات گسترده است.
شایعترین علائم فیبروز کیستیک
علائم CF از نوزادی تا بزرگسالی ادامه دارند و شدت آن وابسته به نوع جهش CFTR است. کودکان مبتلا دیر وزن میگیرند و بهسختی رشد میکنند. تهوع، نفخ و اسهال چرب از نشانههای گوارشیاند.
در بزرگسالان، مشکل عمده تنگی نفس و سرفه همراه مخاط غلیظ است. این مخاط محیطی مناسب برای رشد باکتریهای مقاوم مثل Pseudomonas aeruginosa ایجاد میکند.
ویژگی بارز ظاهری بیماران، شوری پوست هنگام تماس است. این علامت از افزایش سدیم و کلر در عرق ناشی میشود. به همین دلیل تست تعریق مهمترین روش اولیه تشخیص است.
CF باعث سوءتغذیه مزمن میشود؛ زیرا چربیها و پروتئینها جذب نمیشوند. این وضعیت منجر به ضعف سیستم عضلانی و پوکی استخوان میگردد.
جدول علائم فیبروز کیستیک:
| نوع درگیری | علائم برجسته | توضیح |
|---|---|---|
| تنفسی | سرفه خلطی، خسخس، عفونت ریوی | انسداد راه هوایی با مخاط غلیظ |
| گوارشی | اسهال چرب، نفخ، یبوست | انسداد مجاری پانکراس و جذب ناکامل |
| رشد | وزن کم، سوءتغذیه | جذب ناکافی مواد حیاتی |
| غدد عرق | شوری پوست | اختلال انتقال Na⁺ و Cl⁻ |
در مراحل پیشرفته، اختلال در اکسیژنرسانی میتواند باعث انگشت چماقی یا تغییر شکل ناخنها شود. این علائم هشداردهنده آسیب ریوی مزمن هستند.
تستها و روشهای تشخیص CF
آزمایش تعریق (Sweat Test) رایجترین روش تشخیص است. غلظت کلر بیش از ۶۰ mmol/L در عرق نشانه قطعی CF است. این تست در نوزادان چندروزه قابل انجام است و نتیجهی سریع دارد.
آزمایش ژنتیکی CFTR دومین مرحله تشخیص است. این بررسی با روشهای PCR و توالییابی DNA انجام میشود تا جهشهای ژنی شناسایی شوند. در ایران، بررسی جهشهای اگزونهای ۱۱ و ۱۳ بیشتر توصیه میشود.
در خانوادههایی که سابقه بیماری دارند، PND (Prenatal Diagnosis) برای تشخیص پیش از تولد و PGD (Preimplantation Genetic Diagnosis) برای انتخاب جنین سالم مفید هستند.
تصاویر CT و MRI ریه شدت انسداد و آسیب را مشخص میکنند. در مراحل پیشرفته، تست عملکرد ریوی (Spirometry) برای ارزیابی ظرفیت تنفس تجویز میشود.
تشخیص زودهنگام زندگی بیمار را تغییر میدهد. بسیاری از کودکان اگر تا قبل از ششماهگی تشخیص داده شوند، رشد طبیعی پیدا میکنند.
پزشکان توصیه میکنند آزمایش ژنتیکی برای ازدواجهای فامیلی الزامی شود تا خطر انتقال CF کاهش یابد.
هرچه نوع جهش زودتر شناخته شود، درمان تعدیلکننده CFTR دقیقتر انتخاب میشود و طول عمر بیمار افزایش مییابد.
مدیریت و درمان فیبروز کیستیک
درمان فیبروز کیستیک بر سه محور استوار است: کاهش عفونت، پاکسازی مخاط و تغذیه مؤثر. درمان قطعی وجود ندارد، ولی پیشرفتهای دارویی چشمگیر بودهاند.
داروهای CFTR Modulator شامل Ivacaftor، Lumacaftor، Tezacaftor و Elexacaftor عملکرد پروتئین CFTR را بازمیگردانند و تنفس را آسان میکنند. ترکیب این داروها با آنتیبیوتیکهای هدفمند مانند Ceftriaxone میتواند به تنظیم ژن CFTR کمک کند.
فیزیوتراپی روزانه برای تخلیه مخاط ریه ضروری است. تکنیکهایی مثل Nebulizer Therapy یا ضربههای تنفسی باعث افزایش اکسیژن و کاهش التهاب میشوند.
تغذیه نقش مهمی دارد. بیماران نیاز به رژیم پرکالری و غنی از MCT Oils دارند. مکملهای آنزیمهای پانکراس همراه غذا مصرف میشوند تا جذب چربیها کامل شود.
آنتیاکسیدانها و ویتامینهای محلول در چربی (A، D، E و K) برای حفظ سلامت ضروریاند.
ورزشهای تنفسی، شنا، یوگا و دوچرخهسواری عملکرد ریوی را تقویت میکنند.
بیماران باید از محیطهای آلوده دور بمانند. عفونت با Pseudomonas aeruginosa خطرناک است و باید با داروهای خاص کنترل شود.
پیشرفتهای نوین درمانی
تحقیقات جدید روی Gene Therapy و Stem Cell Therapy امید تازهای ایجاد کردهاند. در ژندرمانی، نسخه سالم ژن CFTR داخل سلولهای تنفسی تزریق میشود و عملکرد طبیعی بازمیگردد.
دو رویکرد اصلی:
- یکپارچه (Integrative): اتصال ژن سالم به DNA سلول میزبان.
- غیر یکپارچه (Non-Integrative): انتقال موقت ژن با پلاسمید یا ویروس حامل.
کشف سلولهای یونوسیتهای ریوی (Lung Ionocytes) تحول بزرگی در فهم CF بود. این سلولها با جذب مایع نه ترشح، نقش مخالف سلولهای اپیتلیال دارند. میزان CFTR در آنها بسیار بالاست و هدف اصلی درمانهای مولکولی آیندهاند.
آزمایشهای بالینی در آمریکا و اروپا نشان دادهاند که ترکیب Elexacaftor/Ivacaftor/Tezacaftor تا ۸۰٪ عملکرد CFTR را در بیماران خاص بازمیگرداند.
در ایران نیز استفاده از ژندرمانی سفارشی در فاز مطالعات ژنتیکی است. محققان به دنبال طراحی ناقلهای بومی برای اصلاح جهشهای رایج اگزونهای ۱۱ و ۱۳ هستند.
فناوریهای نانودارویی نیز برای رساندن مواد فعال به ریه در حال توسعهاند.
هدف نهایی، حذف کامل جهش CFTR از زنجیره وراثتی طی نسلهای آینده است.
طول عمر و کیفیت زندگی بیماران CF
طول عمر بیماران CF در ده سال اخیر از ۲۵ سال به حدود ۴۵ سال افزایش یافته است. درمانهای هدفمند و مراقبت تخصصی این جهش را ایجاد کردهاند. بیماران امروز قادرند تحصیل و شغل معمول داشته باشند و عمر طولانیتری تجربه کنند.
کیفیت زندگی به فیزیوتراپی و رعایت نظافت ریه بستگی دارد. پاکسازی مخاط، تغذیه قوی و کنترل عفونتها سه اصل حیاتیاند.
زندگی فعال نقش مهمی دارد. ورزش روزانه جریان هوا را بهبود میدهد و از تجمع بلغم جلوگیری میکند.
حمایت روانی خانواده و گروههای حمایتی تحت عنوان CF Care Network در دنیا مؤثر بودهاند و عملکرد روانی بیماران را بالا بردهاند.
در بیماران غیرپیچیده، استفاده از CFTR Modulators میتواند روند بیماری را کند کند.
تغذیه صحیح شامل مصرف پروتئین بالا، مکملهای آنزیمی و ویتامینهای محلول در چربی است. هر وعده غذایی باید پرکالری باشد تا نیاز متابولیکی بیمار را پوشش دهد.
مراقبت منظم و ارتباط نزدیک با پزشک، کلید حفظ کیفیت زندگی و کاهش مرگومیر است.
مشاوره ژنتیک و پیشگیری
مشاوره ژنتیک (Genetic Counseling) نقش حیاتی در پیشگیری از تولد بیماران CF دارد. با بررسی ژنهای CFTR در والدین، خطر ابتلا در فرزند محاسبه میشود. اگر هر دو ناقل باشند، انجام PGD برای انتخاب جنین سالم توصیه میشود.
در ایران غربالگری زوجهای فامیلی ضروری است. بررسی جهشهای خاص مثل F508del یا اگزونهای ۱۱ و ۱۳ باید در دستور کار مراکز ناباروری قرار گیرد.
PND (Prenatal Diagnosis) قبل از هفته دوازدهم بارداری میتواند وجود ژن معیوب را تأیید کند. این آزمایش کمک میکند تصمیمگیریهای زودهنگام و مسئولانه انجام شود.
مشاوره ژنتیک نهتنها از وقوع بیماری جلوگیری میکند بلکه خانواده را برای زندگی سالم آماده میسازد.
سازمانهای بهداشتی باید آموزش عمومی درباره CF را تقویت کنند تا آگاهی جامعه بالا رود.
تشکیل بانک اطلاعات ژن CFTR ایرانی برای غربالگری ملی ضروری است. این اقدام میتواند پایه برنامههای پیشگیرانه نسلهای آینده باشد.
پیشگیری دقیقتر از درمان است؛ جلوگیری از تولد حتی یک کودک مبتلا، هدف اصلی برنامههای سلامت ژنتیک است.
فیبروز کیستیک در ایران
در ایران حدود ۳۰۰۰ تا ۴۰۰۰ بیمار CF شناسایی شدهاند. نبود سامانه جامع ثبت بیماران، کاهش آگاهی عمومی و دسترسی محدود به داروها، چالشهای مهم نظام سلامتاند.
اکثر موارد در ازدواجهای فامیلی گزارش شدهاند. تحقیقات دانشگاه تبریز نشان داده جهشهای خاص در اگزونهای ۱۱، ۱۳ و ۲۲ ژن CFTR در ایرانیان بیشترند.
داروهای CFTR Modulator در کشور کمیاب و گران هستند. واردات آنها باید در اولویت طرحهای دارویی ملی قرار گیرد.
آزمایش عرق و ژنتیک در برخی مراکز مانند آزمایشگاه وحید و مرکز رشد بوعلی انجام میشود، اما پوشش سراسری ندارد.
آگاهی مدارس و والدین در شناسایی زودهنگام علائم حیاتی است. بوسیدن نوزاد با پوست شور یا سرفههای مزمن طولانی نباید نادیده گرفته شود.
درمان بیماران نیازمند تیم چندتخصصی شامل پزشک ریه، متخصص تغذیه، و مشاور ژنتیک است.
توسعه برنامههای CF Care Center بومی میتواند مدیریت بیماری را در سطح کشوری بهبود دهد. ایران ظرفیت بالایی برای راهاندازی این طرحها دارد.
نتیجهگیری
فیبروز کیستیک (CF) یک بیماری ارثی پیچیده است که با نقص ژن CFTR آغاز میشود و چند اندام حیاتی را درگیر میکند. شناخت دقیق مکانیزم ژنی و علائم اولیه، مسیر تشخیص سریعتر را هموار میکند.
امروزه داروهای CFTR Modulator و پیشرفتهای Gene Therapy باعث بهبود عملکرد سلولی شدهاند و بیماران را به سنین بالاتر رساندهاند.
پیشگیری، غربالگری و مشاوره ژنتیک مؤثرترین راه کاهش شیوع بیماری است.
هدف آینده، اصلاح ژن CFTR در سطح مولکولی و حذف جهش از نسل انسانی است.
آگاهی عمومی و ایجاد پایگاه داده ژن ایرانی باید در اولویت نظام سلامت قرار گیرد تا این بیماری خاموش کنترل شود.
درک عمیقتر از فیبروز کیستیک تنها با شناخت هورمونها کامل میشود؛ یکی از کلیدیترین آنها هورمون پروژسترون است که در مجله اوریکا بهصورت علمی بررسی شده. نقش این هورمون در تنظیم عملکرد تنفسی، ایمنی و باروری به اندازهای مهم است که بدون شناخت آن، تحلیل تأثیرات CF بر بدن ناقص میماند. مطالعه آن دریچهای تازه به پیوند میان ژنتیک و هورمونشناسی باز میکند.
سوالات متداول
- آیا فیبروز کیستیک درمان قطعی دارد؟ درمان قطعی ندارد، ولی داروهای تعدیلکننده CFTR شرایط را پایدار میکنند.
- طول عمر بیماران CF چقدر است؟ حدود ۴۵ تا ۵۰ سال با درمان مناسب و مراقبت روزانه.
- چرا پوست بیماران شور است؟ بهدلیل ضعف انتقال یونهای سدیم و کلر در غدد عرق.
- آیا ازدواج فامیلی خطر CF را افزایش میدهد؟ بله، دو ناقل ژن CFTR احتمال ابتلا را ۲۵٪ میکنند.
- نقش یونوسیتهای ریوی در درمان چیست؟ این سلولها هدف ژندرمانی هستند و CFTR بالایی دارند.